氟吡苯醯胺 (Tucidinostat/Chidamide)
Tucidinostat在台灣的第一個適應症 - 合併Exemestane用於治療HR陽性, Her-2陰性晚期乳癌
疾病背景
乳癌發生率為女性好發癌症的第一位,目前乳癌的初分型有3類,即荷爾蒙受體(HR)陽性、HER-2陽性以及三陰性乳癌。其中荷爾蒙受體(HR)陽性病患所佔的比例最高,約65~75%,此類病患其癌細胞表面有雌激素受體(ER)及黃體激素受體(PR),容易受到荷爾蒙的刺激而加速成長,所以這類病患治療方式著重利用內分泌療法進行治療。雖然,內分泌療法可聯合CDK4/6抑制劑在這些患者中有效阻止疾病進展,但約有一半患者在24個月後會發生疾病進展/復發或抗藥性產生。因此,對於內分泌療法聯合CDK4/6抑制劑的一線治療後所產生的雙重抗藥性是臨床上極待解決的重要難題和挑戰。
Tucodinostat聯合Exemestane藉由獨特表觀遺傳調控機制,將可有效克服一線使用內分泌療法聯合CDK4/6抑制劑所引發的雙重抗藥性問題,提供二線治療新的選擇。
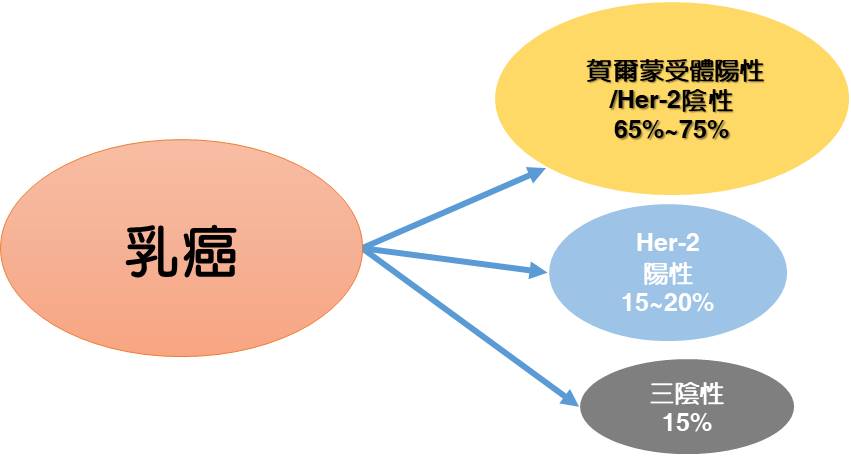
Tucidinostat用於HR+/HER-2-晚期乳癌臨床動機
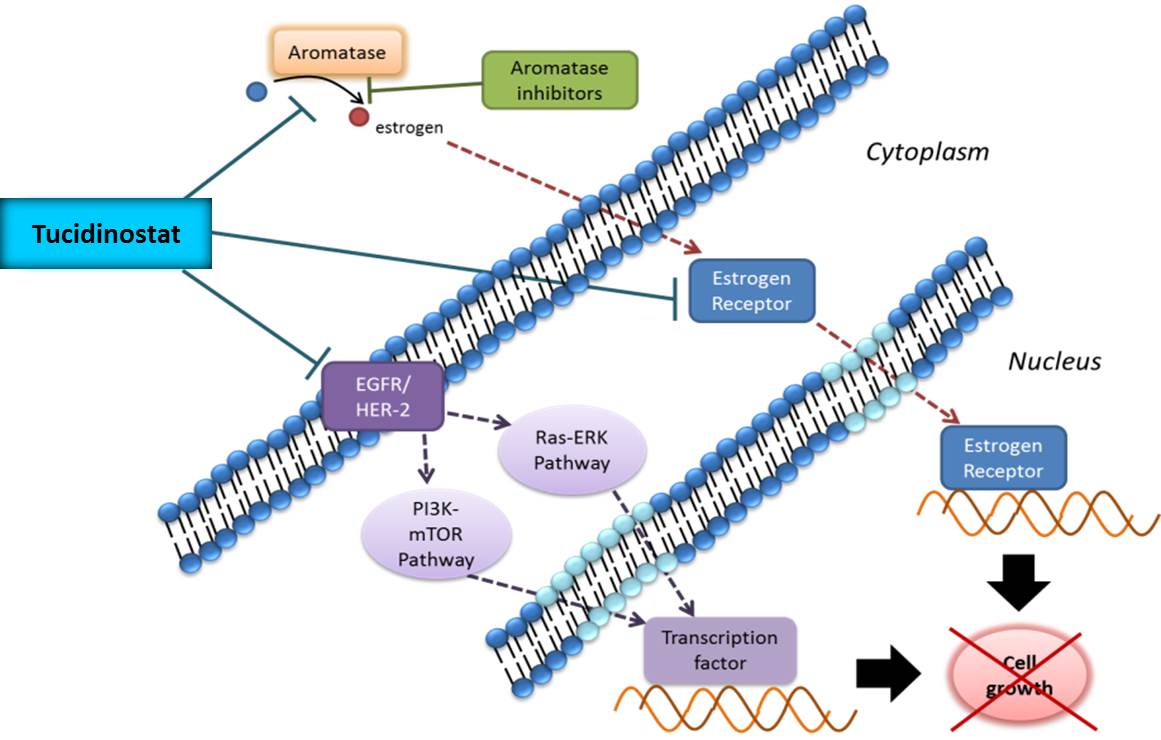
Tucidinostat用於乳癌臨床試驗的研發動機,主要基於下列幾個研究成果: (1) G. Sabnis 等人於2007年研究指出,HDACi 可以有效的降低乳癌細胞對AI (aromatase inhibitor)產生的抗藥性,增加治療敏感度;(2) CW Chou 等人於2011年研究指出,HDACi可以抑制大腸癌細胞的EGFR表現;(3) BM Müller等人於2013年說明,當乳癌HR陽性病患其腫瘤HDACs 1、2、3的表現量顯著高於HR陰性的病患,會影響疾病進展、腫瘤轉移,進而降低病患存活率。Tucidinostat的作用機制主要是抑制HDACs 1、2、3及10的表現,若用於治療HR陽性乳癌病患,藉由減少乳癌細胞HDACs 1、2、3的表現量,有機會減緩疾病進展,並延長病患生存期;(4) 臨床試驗候選藥物Entinostat (屬於苯醯胺類的HDACi)合併Exemestane,用於已經對非固醇類AI產生抗藥或復發的病人,在2013年9月獲得FDA授予突破性療法,有機會逆轉長期使用非固醇類AI所造成的抗藥性,獲得新的敏感性進而緩解疾病。
基於這些理由,深圳微芯生物開始進行臨床III期的open stage試驗,先收納20名HR+/Her-2-晚期乳癌,既往至少使用過一次內分泌療法治療失敗或復發的病患,使用Tucidinostat聯合Exemestane治療。結果顯示,病患的mPFS有7.6個月(單藥的Exemestane mPFS約在3個多月),兩個藥物聯合無藥物交互作用,不良反應安全性可控。
華上生醫與深圳微芯生物合作進行樞紐三期雙盲臨床試驗,分別在台灣與中國收納相同條件共420位病患。2019年11月,深圳微芯生物率先解盲成功,獲得NMPA頒發Tucidinostat新增適應症乳癌的藥證。華上生醫同步收案,解盲也獲得成功,在台灣提交新藥查驗登記申請,在2023年3月獲得TFDA上市許可,是Tucidinostat在台灣的首張藥證。這也是全球第一個表觀遺傳調控劑(Tucidinostat),藉由獨特的表觀遺傳調控機制,增加內分泌療法的敏感性,降低其抗藥性,用於 HR+/Her-2-晚期乳癌的第二線治療。
Tucidinostat合併Exemestane治療HR+/Her-2-晚期乳癌的可能機制。
Tucidinostat用於治療HR+/HER-2-晚期乳癌樞紐臨床三期試驗(CDM301)
臨床試驗名稱為CDM301,收納HR+/Her-2-晚期乳癌病患,既往使用過至少一次的內分泌療法治療失敗或復發的病患,使用Tucidinostat聯合Exemestane治療。依據入組病患的內臟轉移與否進行分層,並以2:1進行兩組的隨機分配,進入試驗組及安慰劑組,直到病患服用試驗藥物疾病進展或因藥物毒性無法耐受而退出試驗,主要療效指標以臨床研究者為主的PFS。試驗時間約5年。
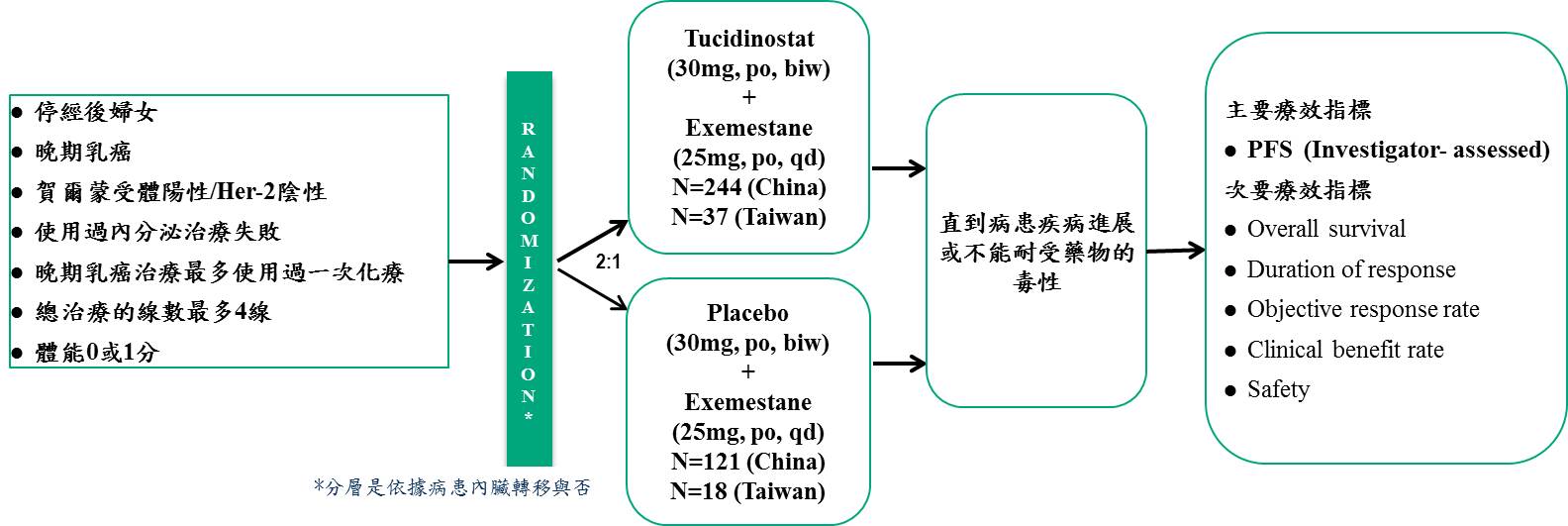
療效評估
CDM301是一個設計良好的大型臨床試驗、安慰劑對照、隨機、多中心在台灣與中國收案的樞紐三期臨床試驗。總計收案420例患者,以2:1隨機分配到Tucidinostat聯合Exemestane組(試驗組)和安慰劑聯合Exemestane組(安慰劑組),分別入組281例和139例。試驗主要終點療效結果,試驗組和安慰劑的mPFS分別為7.4個月和3.7個月(HR=0.716;95% CI, 0.562 ~ 0.911;P=0.0066)。台灣的55位病患數據分析顯示: Tucidinostat聯合Exemestane組(試驗組)和安慰劑聯合Exemestane組(安慰劑組)以2:1隨機分派,分別入組37例和18例。試驗主要終點療效結果,試驗組和安慰劑組的mPFS分別為8.6個月和3.7個月(HR=0.516;95% CI, 0.268 ~ 0.993;P=0.0477)。收案420例患者,試驗的次要終點療效結果,客觀緩解率(ORR):試驗組為16.73%,安慰劑組為7.91%,具有顯著統計差異。
安全性數據
Tucidinostat 聯合Exemestane組常見的不良事件為血液學毒性與腸胃道毒性,皆為可控的不良反應,可藉由調降劑量或暫停用藥來恢復病患的AE。
Tucidinostat滿足HR+/Her-2-晚期乳癌第二線治療
依據NCCN治療指南,HR+/Her-2-晚期乳癌第一線治療主要的推薦以內分泌療法聯合CDK4/6抑制劑作為標準治療。另又依據台灣健保給付規定,HR+/Her-2-晚期乳癌病患終生可以健保給付使用CDK4/6抑制劑24個月,且依據國際文獻報導HR+/Her-2-晚期乳癌第一線治療使用內分泌療法聯合CDK4/6抑制劑都有非常優異的治療效益,mPFS約在24個月。這些理由都傾向於支持,台灣HR+/Her-2-晚期乳癌病患第一線治療就會大多使用內分泌療法聯合CDK4/6抑制劑。
當第一線治療使用內分泌療法聯合CDK4/6抑制劑失敗後,會導致病患同時具有內分泌及CDK4/6雙重抗藥性發生,後續的第二線治療將選擇更有限,主要原因是來自晚期乳癌病患經第一線治療後的雙重抗藥性發生。依據NCCN治療指南推薦,第二線治療能夠使用的藥物相當有限,第一種推薦:若病患從未使用過CDK4/6抑制劑,第二線治療則可以推薦使用CDK4/6抑制劑聯合內分泌療法;第二種推薦: 若病患有PIK3CA突變發生,可以推薦使用Alpelisib (PI3Ki)合併fulvestrant;第三種推薦是病患可以使用Everolimus(mTORi)合併Exemestane。
Tucidinostat (HDACi)聯合Exemestane將是第四種選擇。Tucidinostat屬於表觀遺傳調控劑,研究機理上是可以克服內分泌及CDK4/6長期治療所引發的雙重抗藥性問題。華上生醫將在台灣執行一個真實世界研究,當HR+/Her-2-晚期乳癌第一線治療使用內分泌療法聯合CDK4/6抑制劑治療失敗後,進入第二線治療時使用Tucidinostat聯合Exemestane的治療效益評估。