氟吡苯醯胺 (Tucidinostat/Chidamide)
Tucidinostat (氟吡苯醯胺)新增適應症 -用於治療復發/難治外周T細胞淋巴癌
復發/難治外周T細胞淋巴癌(R/R PTCL)
R/R PTCL歸屬於罕見疾病範疇,依據WHO在2018年的分類多達20多種亞型。R/R PTCL亞型眾多異質性高,且侵犯性強,多年來臨床上缺乏標準的治療藥物,對常規的化療反應率低、耐受性差,易復發,5年的總生存率僅在25%左右。
美國FDA於2018年批准Adcetris (brentuximab vedotin)聯合化療方案作為PTCL一線治療,Adcetris屬於ADC (Antibody-drug conjugates)藥物。該試驗是以傳統治療PTCL的CHOP化療方案為對照組, Adcetris (取代O) + CHP為試驗組。
而美國FDA於2009年、2011年與2014年分別批准了三個以治療R/R PTCL適應症的新藥上市,分別是Pralatrexate (Folotyn®)、Romidepsin (FK228, Istodax®)與Belinostat (PXD101, Beleodaq®);而在中國,CFDA於2014年批准Tucidinostat用於治療R/R PTCL為適應症的新藥上市。在日本,厚生勞動省於2021年批准Tucidinostat用於治療R/R PTCL為適應症的新藥上市。
目前,四個治療R/R PTCL的國際上市藥物中僅有Folotyn®進入台灣市場,對於台灣R/R PTCL患者而言,有效、且安全的治療藥物臨床需求仍未被滿足。
Tucidinostat治療R/R PTCL在中國及日本樞紐試驗的有效性總體評價
中國的樞紐臨床數據
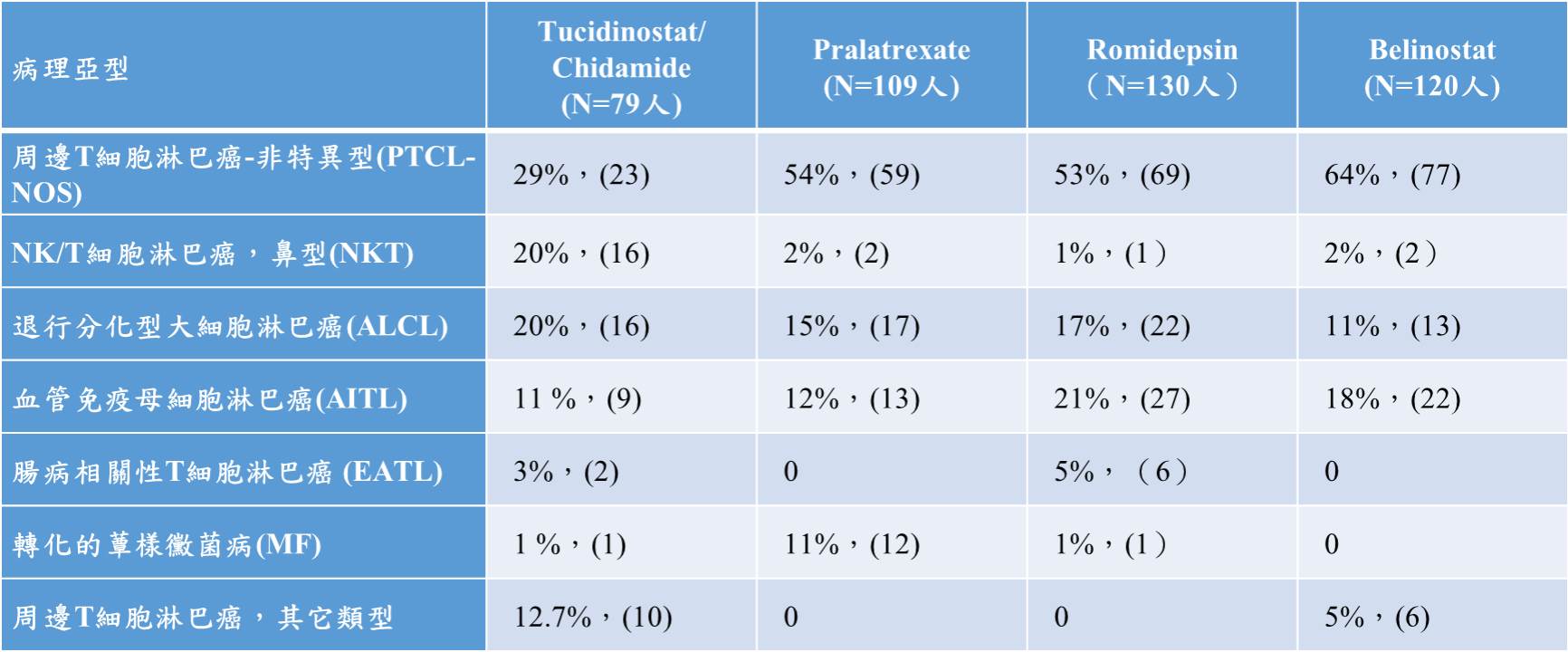
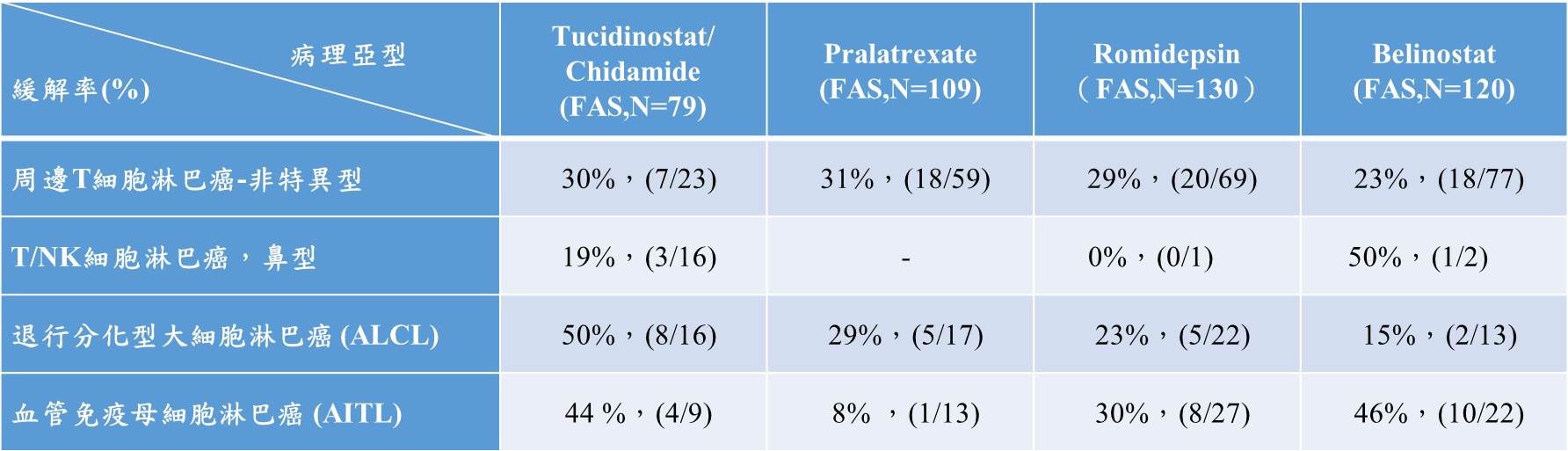
Tucidinostat治療R/R PTCL的臨床試驗主要療效指標為客觀緩解率(ORR, Overall Response Rate),與其他國際上三個新藥樞紐試驗中的主要療效指標相同。Tucidinostat在樞紐II期臨床試驗,以每週2次,每次30 mg劑量下,臨床研究者判讀客觀緩解率為29.1%(23/79),95%CI:19.4%~40.4%。Tucidinostat與三個國際新藥樞紐臨床試驗療效評價方案一致,除了臨床研究者對療效進行評價以外,還設立了獨立專家委員會(IRC)對樞紐臨床試驗的主要療效指標——客觀緩解率進行獨立評價。四個新藥在治療復發、難治的PTCL客觀緩解率分別為28%、27%、25%與26%。Tucidinostat與三個國際新藥在主要療效指標上的對比情況,三者大致療效相近。
除了主要療效指標-客觀緩解率之外,Tucidinostat樞紐II期臨床試驗結果顯示,FAS人群3個月持續緩解率(DORR)為24.1%(19/79),遠高於Pralatrexate的12%(13/109),顯示Tucidinostat針對復發或難治性PTCL可能比Pralatrexate具有更好的持續療效。Tucidinostat在2014年12月獲得中國NMPA批准藥證上市。
日本與南韓樞紐臨床數據
在日本及南韓以HBI-8000 (Tucidinostat)單藥治療R/R PTCL的臨床試驗,以每週2次,每次40 mg劑量投予,主要療效指標為客觀緩解率(ORR, Overall Response Rate),以IOERC(獨立綜合療效評估委員會)來進行ORR評估獲得46%,疾病控制率為72%,其中以PTCL的第二大亞型AITL獲得ORR88%。Tucidinostat在2021年11月30日獲得日本厚生勞動省批准藥證上市。
表一、Tucidinostat與國際R/R PTCL上市藥物主要入組病理亞型對比(中國臨床數據)
表二、Tucidinostat與國際R/R PTCL上市藥物占比>10%病理亞型的緩解率對比 (中國臨床數據)
獲益與風險評估
Tucidinostat是亞型選擇性的HDAC抑制劑,根據各自以R/R PTCL為適應症的樞紐臨床試驗綜合結果對比分析,綜合療效評價結果顯示,Tucidinostat與國際上三個藥物相比,可能具有更好的療效(日本與南韓的ORR46%),或至少療效相當(中國的ORR28%)。
給藥便利性和服藥依從性
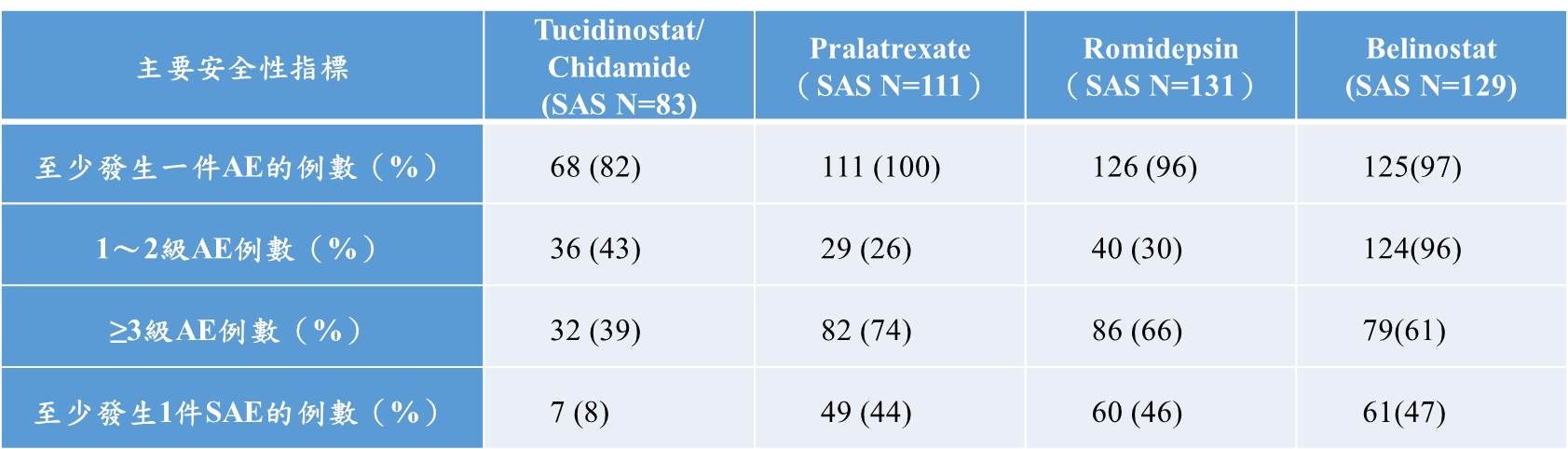
Tucidinostat為口服製劑,以每週兩次的方式服藥,對照國際已經上市的三個靜脈注射治療用藥,具有更方便的臨床服藥方式和更好依從性。即便是口服給藥,較易造成腹瀉、噁心等以消化道為主要表現的毒性發生率和嚴重程度,及嚴重不良事件(SAE)都遠低於三個靜脈注射藥物。下表對比四個藥物安全性分析。
表三、Tucidinostat與國際R/R PTCL上市藥物發生不良事件的狀況(中國臨床數據)
Tucidinostat在台灣的R/R PTCL恩慈治療及臨床試驗
2020年2月,台灣TFDA首次批准華上生醫在台灣生產製造的Tucidinostat (台灣商品名: 剋必達®/Kepida®) 5毫克錠劑,用於治療復發/難治的外周T細胞淋巴癌的恩慈治療,約2年多無償提供恩慈治療用藥,總計有36位病患使用並獲得治療效益。
在這些台灣恩慈治療病患中,主要的疾病亞型如下: PTCL-NOS, AITL, NK/T Lymphoma, ALK-/ALK+ ALCL, MEITL, ATL/L。
依據國際性的大規模研究數據顯示,復發/難治外周T細胞淋巴癌的中位生存期只有5.8個月。而在台灣恩慈治療病患中有多位病患使用剋必達錠劑恩慈治療超過1年以上,療效顯著,ORR約45%,安全可控。
目前華上生醫已經遞交Tucidinostat治療復發/難治外周T細胞淋巴癌新藥查驗登記,但依據TFDA的審查及補件要求,華上生醫將在台灣執行一小規模臨床試驗以符合新藥查驗登記。
Tucidinostat可能的新增適應症 - 合併R-CHOP用於MYC/BCL-2雙表達彌漫大B細胞淋巴癌的第一線治療
彌漫大B細胞淋巴瘤(Diffuse large B Cell lymphoma,DLBCL)是 NHL中最常見的類型,在歐美地區占成人NHL的30~40%。依據2016年台灣癌登資料顯示,新診斷罹患惡性淋巴癌總共有3,426人,其中屬於NHL佔大宗約有2,474人,這其中有2,160人罹患B細胞淋巴癌,而屬於瀰漫大B細胞淋巴癌為1,326人,約占整個NHL的53.6%,約占所有惡性淋巴癌的38.7%。
依據2016年台灣癌登資料顯示,60歲以上新診斷DLBCL為909人,佔該年度DLBCL總罹患人數1,326人的68.5%。約有54.6%的台灣DLBCL新診斷時為III-IV期。
MYC/BCL-2雙表達DLBCL約占所有DLBCL的30%,使用標準DLBCL的治療藥物R-CHOP治療效果相當有限,容易復發。全球尚無批准MYC/BCL-2雙表達DLBCL的新藥,臨床需求相當殷切。
DLBCL的治療現狀
(1)R-CHOP是DLBCL標準第一線治療
DLBCL屬於一種侵襲性NHL,自然病程相對較短,一定比例的患者可以在接受適當治療後得到治癒。既往,DLBCL的治療以化療CHOP為主,患者在接受包含蒽環類藥物的聯合化療後,約1/3的患者生存期在5年以上。莫須瘤 (Rituximab)聯合化學治療方案改善了DLBCL患者的完全緩解(CR)率和長期生存率,因此,NCCN治療指南推薦Rituximab(R)聯合cyclophosphamide、doxorubicin、vincristine、prednisone(R-CHOP)方案作為DLBCL的標準第一線治療方案。但遺憾的是,目前仍有約1/3的患者對第一線R-CHOP治療無效或早期復發,有些臨床研究試圖通過”R-CHOP + X” 聯合用藥方案來改善這部分患者的預後,但迄今尚未獲得成功。Hans分型等預後分層因子尚不能完全解釋該部分患者人群的特點,療效急待提高。
(2)R-CHOP對“MYC/BCL-2雙表達”DLBCL的療效不佳
研究發現,臨床上部分DLBCL患者存在MYC和BCL-2蛋白的過度表達,而對於MYC/BCL-2同時過度表達則稱為“MYC/BCL-2雙表達”淋巴瘤(Dual-expressor lymphoma,DEL),國際研究報告顯示MYC/BCL-2雙表達的臨床檢出率高達29~45%,顯著高於MYC/BCL-2基因重排的“雙打擊”淋巴瘤(Double-hit lymphoma,DHL)。中國的研究報告顯示DEL臨床檢出率為32~36%。“MYC/BCL-2雙表達”的標準多採用表達陽性的免疫組織化學染色WHO標準:MYC≥40%,BCL-2 ≥50%,且不伴有MYC和BCL-2和/或BCL-6基因的重排。台灣目前尚未有完整大規模調查報告分析DEL的流行病學及罹患人數占比。根據華上生醫向多家醫學中心臨床醫師訪談結果,推估”MYC/BCL-2雙表達”亞型病患的罹患率可能落在20-30%。以2016年癌登資料顯示,當年度新診斷DLBCL為1,326人,具有”MYC/BCL-2雙表達”亞型的DLBCL可能有300多位病患左右,病患人數少。
台灣多位血液腫瘤科醫師表示,儘管這類亞型病患僅占DLBCL的20-30%,但其R-CHOP治療的預後及反應率遠低於非”MYC/BCL-2雙表達”的DLBCL,臨床需求尚未被滿足,仍迫切需要新的有效藥物提供治療。
Tucidinostat聯合R-CHOP的臨床動機
R-CHOP對MYC/BCL-2雙表達DLBCL的療效不佳,因為MYC/BCL-2雙表達DLBCL患者往往具備一些預後差的臨床病理特徵,包括病患年齡大、高的腫瘤分期、多個部位受累、高的國際預後指數(IPI)以及治療反應差等,雖然目前有兩個新藥聯合R-CHOP在MYC/BCL-2雙表達DLBCL進行樞紐三期臨床試驗,但在臨床需求尚未被滿足,仍迫切需要新的有效藥物提供治療。
針對MYC/BCL-2雙表達DLBCL的治療,進行Tucidinostat多項細胞及動物的機制研究,發現:
1. Tucidinostat可以通過對DNA損傷修復過程的抑制,促進蒽環類藥物(如Doxorubicin)對腫瘤細胞的生長抑制和促凋亡活性;
2. Tucidinostat可以誘導DLBCL腫瘤細胞表面的CD20表達從而增強抗CD20單株抗體(如Rituximab)的腫瘤抑制活性;
3. Tucidinostat可以抑制腫瘤細胞中MYC和BCL-2表達,提高標準治療對MYC/BCL-2雙表達DLBCL的療效。
通過上述不同活性機制,Tucidinostat聯合R-CHOP標準治療發揮對DLBCL腫瘤生長的協同抑制效應,特別是對MYC/BCL-2雙表達DLBCL的治療價值。
Tucidinostat可以提供MYC/BCL-2雙表達DLBCL之臨床需求
臨床研究已經表明,MYC/BCL-2雙表達DLBCL患者的R-CHOP治療療效和預後顯著低於非MYC/BCL-2雙表達人群,R-CHOP方案仍有很大的改善空間。目前尚未有前瞻性、大規模臨床研究成功探索MYC/BCL-2雙表達人群的治療,因此,在R-CHOP方案的基礎上,探索MYC/BCL-2的DLBCL雙表達人群有效且相對安全的新型藥物組合,是臨床上一個顯著尚未被滿足的需求。
儘管,目前已有兩個新藥聯合R-CHOP在MYC/BCL-2雙表達DLBCL進行樞紐三期臨床試驗,其中之一是”Ibrutinib + R-CHOP”在60歲以下病患有助於提升mOS、mPFS及EFS,然而在超過60歲以上病患並無顯著差異的,流行病調查顯示,罹患DLBCL病患有將近60%以上的病患是超過60歲。另一個藥物是”Lenalidomide + R-CHOP”,解盲沒有達到主要療效指標。因此,治療MYC/BCL-2雙表達DLBCL有非常殷切的臨床需求。
2022年7月華上生醫的合作夥伴已經完成418位MYC/BCL-2雙表達DLBCL患者入組,以1:1的方式隨機分派進入試驗組(Tucidinostat + R-CHOP)與對照組(安慰劑 + R-CHOP),在2023年2月獨立資料監查委員會(IDMC)評估會議召開,依據解盲數據,IDMC建議深圳微芯生物向中國藥監部門申請有條件上市許可。
華上生醫為了滿足台灣MYC/BCL-2雙表達DLBCL病患治療為首要考量,因此,將竭盡所能依據TFDA/CDE建議,完成Tucidinostat在台灣的新藥查驗登記條件,提供新的治療選擇,滿足MYC/BCL-2雙表達DLBCL病病患治療需求。