表觀免疫活化劑
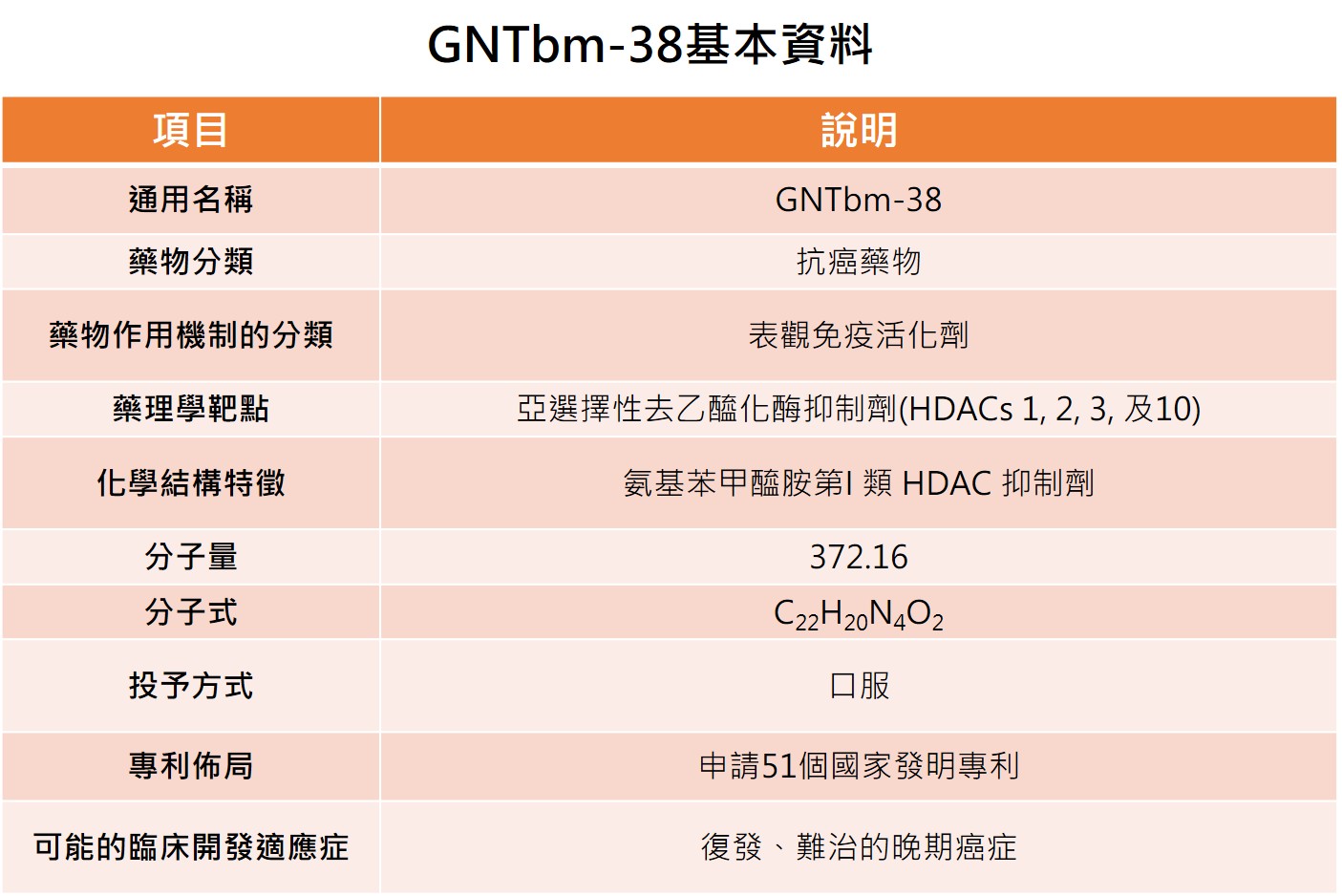
華上生醫研發團隊自主研發全新結構的表觀免疫活化劑,是經過多年研究與開發,篩選出具有創新、小分子、口服、絕佳的表觀遺傳調控與免疫調節活性的雙重功能藥物,命名為GNTbm-38。在酵素、細胞、與動物試驗平台研究顯示,GNTbm-38有絕佳的表觀遺傳與免疫調節活性,當與特定靶點抑制的TKI聯合使用,具有非常優越的重塑腫瘤微環境調控活性,可大幅提高腫瘤應答率。GNTbm-38可以單藥使用,或者聯合特殊靶點抑制的TKI用於腫瘤免疫治療。GNTbm-38化學結構屬於苯醯胺類,係選擇性的class I HDAC抑制劑,華上生醫已經取得包含美國的多國發明專利。GNTbm-38是屬於腫瘤免疫療法藥物的骨幹藥物之一。
GNTbm-38臨床前試驗已經順利完成,將申請IND進行臨床一期安全性試驗,再進入臨床二期試驗,以R/R PTCL為第一適應症,將申請美國孤兒藥授予。當完成取得R/R PTCL藥證後,將持續擴增新適應症,以”GNTbm-38 + Z”,Z可能是獨特靶點抑制的TKI或是anti-PD-1/VEGF雙特異性抗體,可用於治療多種晚期固態腫瘤。
GNTbm-38臨床前試驗已經順利完成,將申請IND進行臨床一期安全性試驗,再進入臨床二期試驗,以R/R PTCL為第一適應症,將申請美國孤兒藥授予。當完成取得R/R PTCL藥證後,將持續擴增新適應症,以”GNTbm-38 + Z”,Z可能是獨特靶點抑制的TKI或是anti-PD-1/VEGF雙特異性抗體,可用於治療多種晚期固態腫瘤。
GNTbm-38的第一個適應症---R/R PTCL
過往多年的研究已經知悉外周T細胞淋巴癌具有高度侵襲性及異質性極大,研究也發現這類癌症的表觀遺傳失控,因此,已有多個HDAC抑制劑進行臨床試驗的驗證獲得批准用於治療R/R PTCL。
T細胞淋巴癌的治療相較於B細胞淋巴癌更為棘手,缺乏標準治療方案,且亞型眾多、異質性大,疾病的嚴重性重大,臨床未滿足需求殷切。GNTbm-38使用小鼠的R/R AITL PDX模型進一步驗證療效,相較於正控制組以Belinostat針劑,GNTbm-38的口服管餵療效優異,再一次確認GNTbm-38的單藥治療可應用於R/R PTCL。
華上生醫將在臨床Ia期收納晚期實體瘤患者進行GNTbm-38劑量爬升試驗,進一步獲得確認DLT/MTD及最佳推薦使用劑量後,進入臨床Ib期試驗,在多個國家收納R/R PTCL病患進行療效與安全性研究。如試驗結果符合預期,將以此臨床試驗結果向美國、歐盟、日本及中國申請GNTbm-38治療R/R PTCL的孤兒藥授予。
獲多國的孤兒藥授予後,GNTbm-38將申請快速審查資格,以一個樞紐II期試驗在美國、加拿大、澳洲、歐洲、日本、台灣、及中國收納病患,如療效與安全性符合預期,將向多國遞交NDA申請,提供新的治療選擇造福R/R PTCL病患。
T細胞淋巴癌的治療相較於B細胞淋巴癌更為棘手,缺乏標準治療方案,且亞型眾多、異質性大,疾病的嚴重性重大,臨床未滿足需求殷切。GNTbm-38使用小鼠的R/R AITL PDX模型進一步驗證療效,相較於正控制組以Belinostat針劑,GNTbm-38的口服管餵療效優異,再一次確認GNTbm-38的單藥治療可應用於R/R PTCL。
華上生醫將在臨床Ia期收納晚期實體瘤患者進行GNTbm-38劑量爬升試驗,進一步獲得確認DLT/MTD及最佳推薦使用劑量後,進入臨床Ib期試驗,在多個國家收納R/R PTCL病患進行療效與安全性研究。如試驗結果符合預期,將以此臨床試驗結果向美國、歐盟、日本及中國申請GNTbm-38治療R/R PTCL的孤兒藥授予。
獲多國的孤兒藥授予後,GNTbm-38將申請快速審查資格,以一個樞紐II期試驗在美國、加拿大、澳洲、歐洲、日本、台灣、及中國收納病患,如療效與安全性符合預期,將向多國遞交NDA申請,提供新的治療選擇造福R/R PTCL病患。
GNTbm-38的新增適應症---MYC/BCL2 DE-DLBCL
瀰漫大B細胞淋巴癌過往使用標準治療方案R-CHOP已有超過20年的時間,CR率約為60-70%。近期的研究發現其實B細胞淋巴癌的異質性相當大,也有很明顯的表觀遺傳失控。其中最難治療的高級別B細胞淋巴癌有MYC、BCL2及BCL6基因重排的問題發生,治療預後相對更差。但所幸這類病患約只有5-8%。然而,另一類MYC/BCL2蛋白高表達的DLBCL (簡稱MYC/BCL2 DE-DLBCL)約有30%,病患相對較多,治療預後也顯著差於沒有高表達的DLBCL病患,儘管WHO並未將此類病患分類為一個獨立新亞型,但很明顯的這類病患以標準R-CHOP治療的CR率較低,且5年的PFS及OS都顯著低於未表達的DLBCL患者。
2024年Tucidinostat聯合R-CHOP顯著提升了MYC/BCL2 DE-DLBCL病患第一線治療的CR率,從61.8%提升至73%,主要療效指標EFS也得到統計顯著差異,在中國獲得了新增適應症藥證,造福MYC/BCL2 DE-DLBCL病患。
華上生醫一直在思考如何能將CR率再提升至85%,GNTbm-38是相較於Tucidinostat擁有更佳的抗癌活性,MYC/BCL2 DE-DLBCL患者唯有獲得CR才能顯著延長其PFS及OS。也因如此,我們希望能強化治療的組合將GNTbm-38 + BTK抑制劑 + Rituximab ± CHOP組合。 如病患在前兩個治療週期以GNTbm-38 + BTK抑制劑 + Rituximab 組合獲得CR,將再持續給6個治療週期;如病患在前兩個治療週期以GNTbm-38 + BTK抑制劑 + Rituximab 組合只獲得PR及SD,病患則需要再聯合化療方案CHOP使用6個治療週期,讓病患從PR/SD轉變成CR。
MYC是癌細胞增生的oncogene大量的表達蛋白質讓DLBCL更不易被殺死,若再加上BCL2高蛋白質表達更不易誘導癌細胞凋亡,MYC/BCL2高表達將讓R-CHOP標準方案治療不易獲得CR。WHO定義MYC 蛋白質表現量高於40%,BCL2蛋白質表現量高於 50%屬於高表達。
2024年Tucidinostat聯合R-CHOP顯著提升了MYC/BCL2 DE-DLBCL病患第一線治療的CR率,從61.8%提升至73%,主要療效指標EFS也得到統計顯著差異,在中國獲得了新增適應症藥證,造福MYC/BCL2 DE-DLBCL病患。
華上生醫一直在思考如何能將CR率再提升至85%,GNTbm-38是相較於Tucidinostat擁有更佳的抗癌活性,MYC/BCL2 DE-DLBCL患者唯有獲得CR才能顯著延長其PFS及OS。也因如此,我們希望能強化治療的組合將GNTbm-38 + BTK抑制劑 + Rituximab ± CHOP組合。 如病患在前兩個治療週期以GNTbm-38 + BTK抑制劑 + Rituximab 組合獲得CR,將再持續給6個治療週期;如病患在前兩個治療週期以GNTbm-38 + BTK抑制劑 + Rituximab 組合只獲得PR及SD,病患則需要再聯合化療方案CHOP使用6個治療週期,讓病患從PR/SD轉變成CR。
MYC是癌細胞增生的oncogene大量的表達蛋白質讓DLBCL更不易被殺死,若再加上BCL2高蛋白質表達更不易誘導癌細胞凋亡,MYC/BCL2高表達將讓R-CHOP標準方案治療不易獲得CR。WHO定義MYC 蛋白質表現量高於40%,BCL2蛋白質表現量高於 50%屬於高表達。
GNTbm-38的新增適應症---MSS/pMMR mCRC
大腸直腸癌是嚴重的致命癌症,全球每年新診斷的病患數約200萬人,因此疾病而死亡的病人數約110萬人,臨床未滿足之需求非常殷切。腫瘤免疫療法只對MSI-H的大腸直腸癌有效,但遺憾的是這類病患約只佔5%。
晚期大腸直腸癌已無法開刀,需要使用全身系統性治療,由於90%的病患屬於MSS/pMMR型,無法使用目前的腫瘤免疫療法治療。但這個僵局在2024年4月份已被突破了,藉由Tucidinostat + anti-PD-1 Ab + Bevacizumab三聯藥物組合,有效重塑腫瘤微環境,將原屬於冷腫瘤的mCRC轉變成熱腫瘤,大幅提升ORR 44%,達到mPFS 7.3個月的歷史性優異數據。
Tucidinostat + anti-PD-1 Ab + Bevacizumab三聯藥物組合已經進入樞紐III期試驗,驗證療效與安全性,以fruquintinib為對照組,以mOS 為臨床試驗主要療效指標,預估將達到積極的解盲正向結果。
GNTbm-38是較Tucidinostat擁有更佳的腫瘤免疫激活特性的表觀遺傳調控劑,將以GNTbm-38聯合anti-PD-1/VEGF雙特異性抗體進行驗證,進行晚期大腸直腸癌第三線治療,收納MSS/pMMR的病患進行POC。GNTbm-38提供免疫激活的獨特藥理貢獻,再聯合anti-PD-1/VEGF雙特異性抗體,將更有助於提供更好的治療效益以及降低副作用,相較於使用各別的anti-PD-1 Ab及Bevacizumab。這也是GNTbm-38在晚期實體瘤的冷腫瘤中最重要的POC驗證。
晚期大腸直腸癌已無法開刀,需要使用全身系統性治療,由於90%的病患屬於MSS/pMMR型,無法使用目前的腫瘤免疫療法治療。但這個僵局在2024年4月份已被突破了,藉由Tucidinostat + anti-PD-1 Ab + Bevacizumab三聯藥物組合,有效重塑腫瘤微環境,將原屬於冷腫瘤的mCRC轉變成熱腫瘤,大幅提升ORR 44%,達到mPFS 7.3個月的歷史性優異數據。
Tucidinostat + anti-PD-1 Ab + Bevacizumab三聯藥物組合已經進入樞紐III期試驗,驗證療效與安全性,以fruquintinib為對照組,以mOS 為臨床試驗主要療效指標,預估將達到積極的解盲正向結果。
GNTbm-38是較Tucidinostat擁有更佳的腫瘤免疫激活特性的表觀遺傳調控劑,將以GNTbm-38聯合anti-PD-1/VEGF雙特異性抗體進行驗證,進行晚期大腸直腸癌第三線治療,收納MSS/pMMR的病患進行POC。GNTbm-38提供免疫激活的獨特藥理貢獻,再聯合anti-PD-1/VEGF雙特異性抗體,將更有助於提供更好的治療效益以及降低副作用,相較於使用各別的anti-PD-1 Ab及Bevacizumab。這也是GNTbm-38在晚期實體瘤的冷腫瘤中最重要的POC驗證。