氟吡苯醯胺 (Tucidinostat/Chidamide)
Tucidinostat在台灣的第一個適應症 - 合併Exemestane用於治療HR陽性, Her-2陰性晚期乳癌
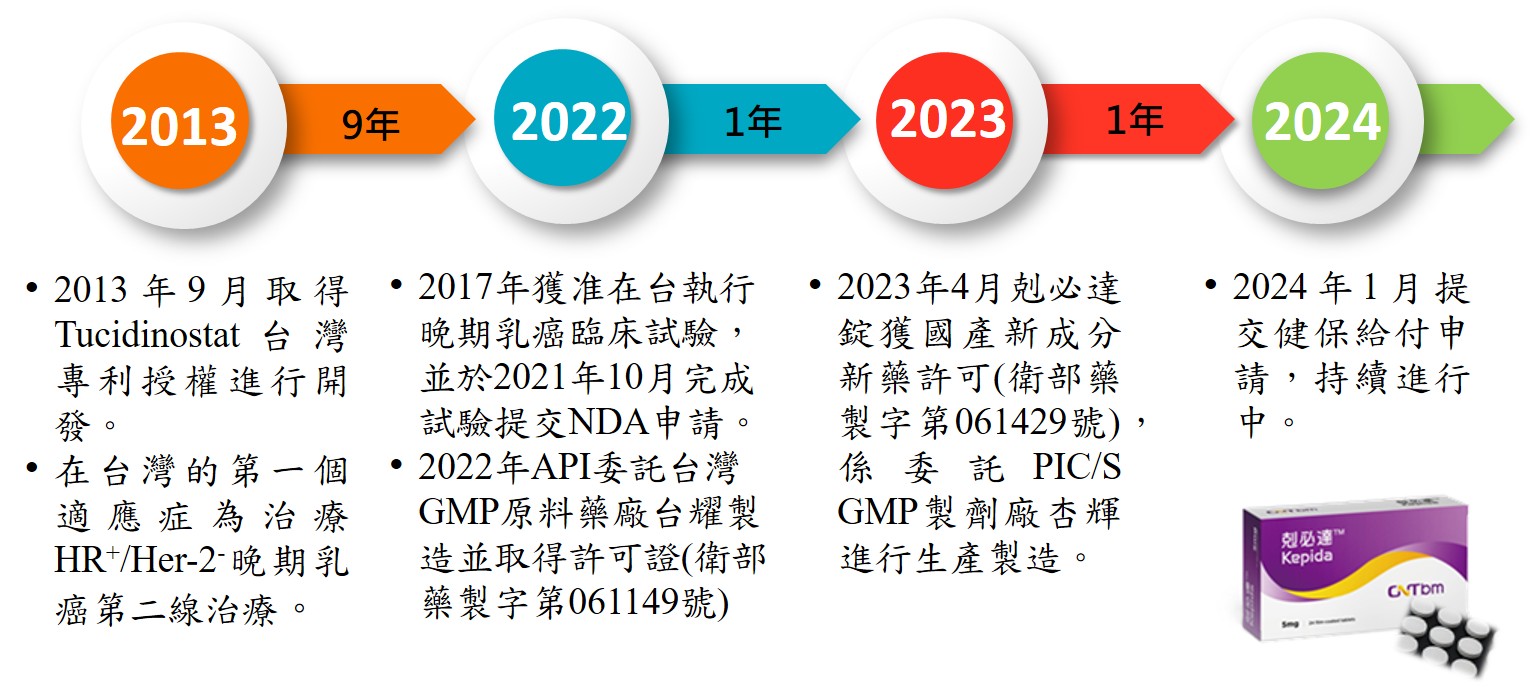
剋必達®在台灣開發10年獲得國產新成分新藥的藥證
氟吡苯醯胺的台灣商品名為剋必達®(英文成名:Tucidinostat),為新一代口服表觀遺傳調控劑(Epigenetic Modulator),是一種亞選擇性HDAC抑制劑,華上生醫耗時10年,投入數億研發成本,取得國產新成分新藥的藥證。
Tucidinostat用於治療HR+/HER-2-晚期乳癌樞紐臨床三期試驗(CDM301)
華上生醫遞交乳癌臨床三期試驗的計畫書給TFDA/CDE審查,並獲得TFDA/CDE建議,試驗的設計與收納病患條件與中國所執行的臨床試驗一樣,並建議台灣的臨床數據與中國的臨床數據合併作為本試驗的臨床試驗終點。
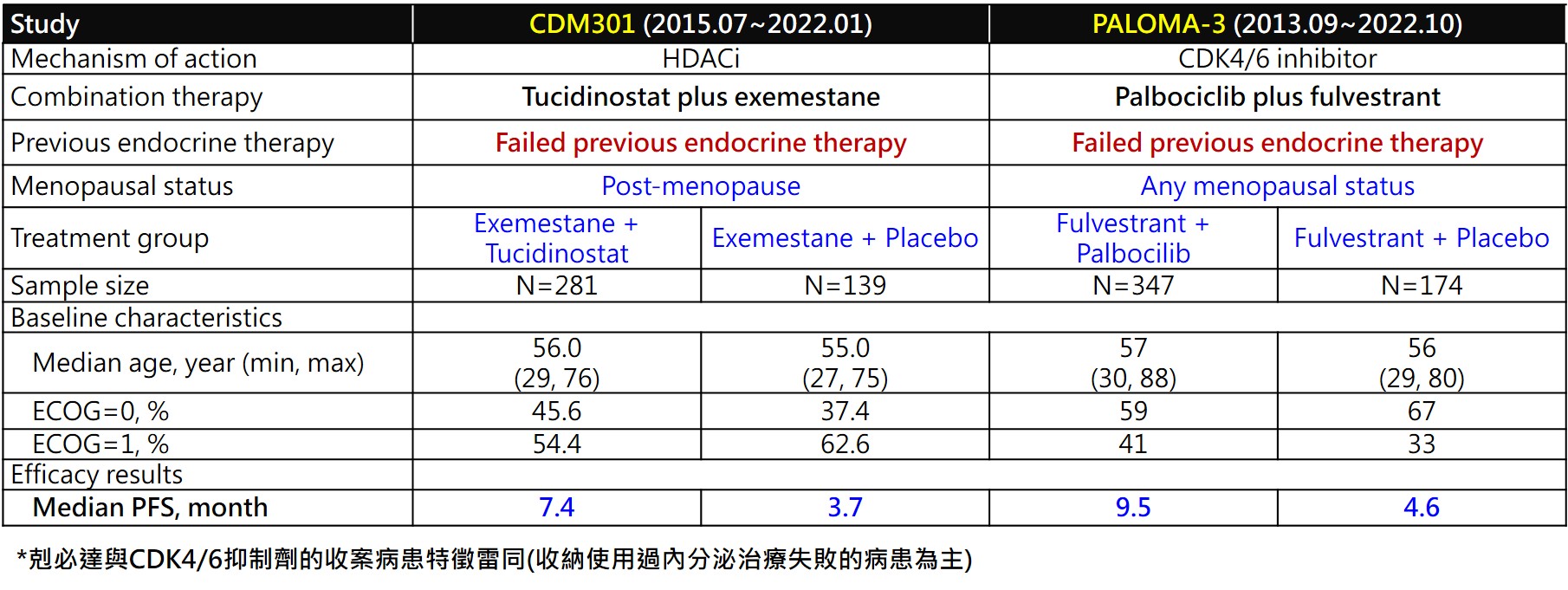
本試驗的臨床試驗名稱為CDM301,收納HR+/Her-2-晚期乳癌病患,既往使用過至少一次的內分泌療法治療失敗或復發的病患,使用Tucidinostat聯合Exemestane治療。依據入組病患的內臟轉移與否進行分層,並以2:1進行兩組的隨機分配,進入試驗組及安慰劑組,直到病患服用試驗藥物疾病進展或因藥物毒性無法耐受而退出試驗,主要療效指標以臨床研究者為主的PFS。試驗時間約5年。
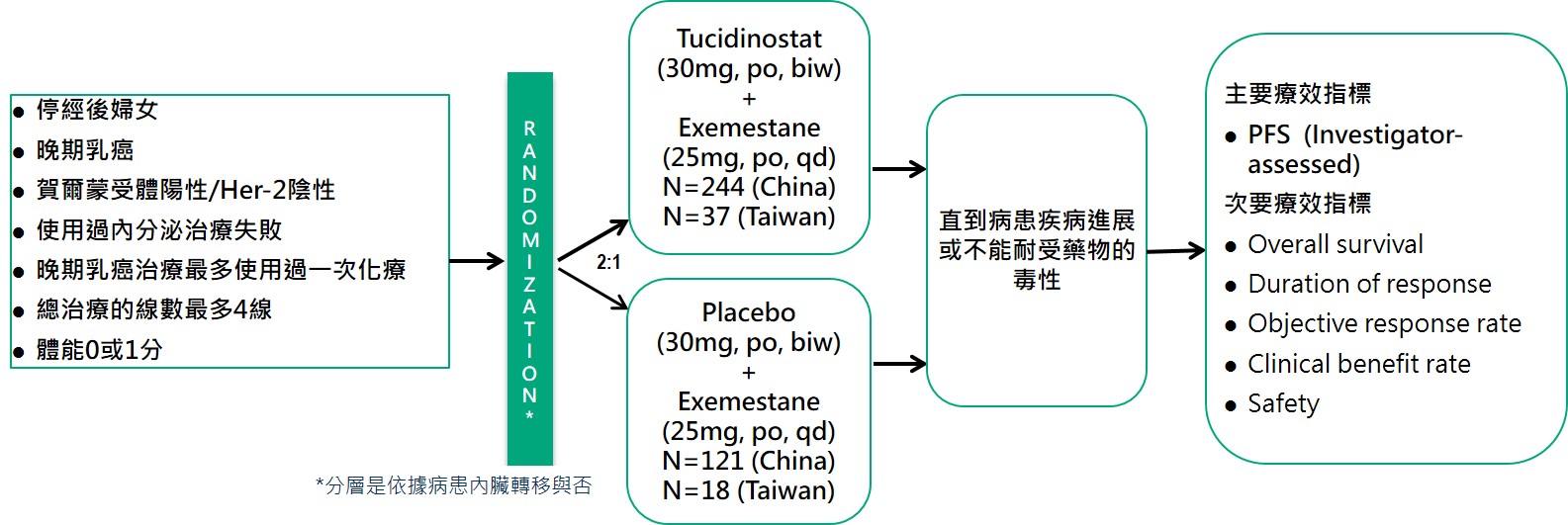
療效評估
CDM301是一個設計良好的大型臨床試驗、安慰劑對照、隨機、多中心在台灣與中國收案的樞紐三期臨床試驗。總計收案420例患者,以2:1隨機分配到Tucidinostat聯合Exemestane組(試驗組)和安慰劑聯合Exemestane組(安慰劑組),分別入組281例和139例。試驗主要終點療效結果,試驗組和安慰劑的mPFS分別為7.4個月和3.7個月(HR=0.716;95% CI, 0.562 ~ 0.911;P=0.0066)。台灣的55位病患數據分析顯示: Tucidinostat聯合Exemestane組(試驗組)和安慰劑聯合Exemestane組(安慰劑組)以2:1隨機分派,分別入組37例和18例。試驗主要終點療效結果,試驗組和安慰劑組的mPFS分別為8.6個月和3.7個月(HR=0.516;95% CI, 0.268 ~ 0.993;P=0.0477)。收案420例患者,試驗的次要終點療效結果,客觀緩解率(ORR):試驗組為16.73%,安慰劑組為7.91%,具有顯著統計差異。
安全性數據
Tucidinostat 聯合Exemestane組常見的不良事件為血液學毒性與腸胃道毒性,皆為可控的不良反應,可藉由調降劑量或暫停用藥來恢復病患的AE。
Tucidinostat滿足HR+/Her-2-晚期乳癌第二線治療
依據NCCN治療指南及台灣乳房醫學會專家共識,HR+/Her-2-晚期乳癌第一線治療主要的推薦以內分泌療法聯合CDK4/6抑制劑作為標準治療。另又依據台灣健保給付規定,HR+/Her-2-晚期乳癌病患終生可以健保給付使用CDK4/6抑制劑24個月,且依據國際文獻報導HR+/Her-2-晚期乳癌第一線治療使用內分泌療法聯合CDK4/6抑制劑都有非常優異的治療效益,mPFS約在24個月。這些理由都傾向於支持,約有70%台灣HR+/Her-2-晚期乳癌病患在第一線治療就會使用內分泌療法聯合CDK4/6抑制劑。
當第一線治療使用內分泌療法聯合CDK4/6抑制劑失敗後,會導致病患同時具有內分泌及CDK4/6雙重抗藥性發生,後續的第二線治療選擇將更有限,主要原因是來自晚期乳癌病患經第一線治療後的雙重抗藥性發生。依據NCCN治療指南推薦,第二線治療能夠使用的藥物相當有限,第一種推薦:若病患從未使用過CDK4/6抑制劑,則第二線治療可以推薦使用CDK4/6抑制劑聯合內分泌療法;第二種推薦: 若病患有PIK3CA突變發生,可以推薦使用Alpelisib (PI3Ki)合併fulvestrant;第三種推薦是病患可以使用Everolimus (mTORi)合併Exemestane。
Tucidinostat (HDACi)聯合Exemestane將提供多一種選擇。Tucidinostat屬於表觀遺傳調控劑,主要是更深層調控基因的表達,這與現行已經批准的藥物作用機制顯著不同。研究機理上是可以克服內分泌及CDK4/6長期治療所引發的雙重抗藥性問題。華上生醫將在台灣執行一個真實世界研究,當HR+/Her-2-晚期乳癌第一線治療使用內分泌療法聯合CDK4/6抑制劑治療失敗後,進入第二線治療時使用Tucidinostat聯合Exemestane的治療效益評估。
Tucidinostat可能改善第一線治療HR+/Her-2-晚期乳癌使用內分泌療法聯合CDK4/6抑制劑所產生的雙重抗藥性問題
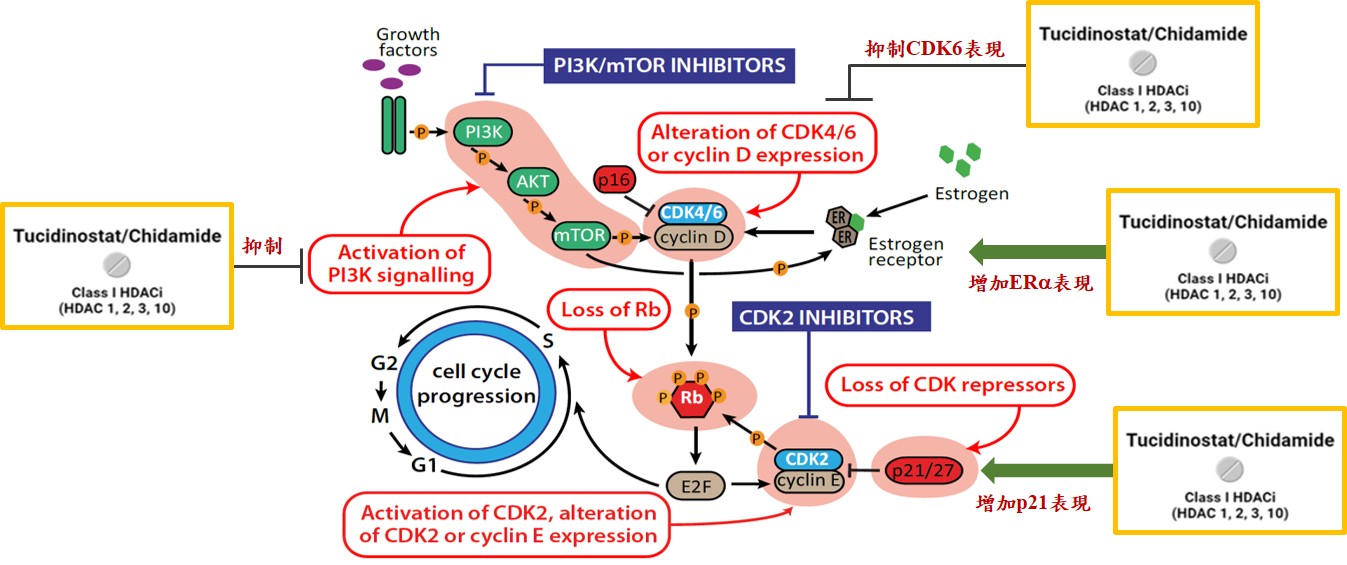
剋必達®之不同的新藥理機制提供晚期乳癌第二線治療新選擇
臨床急迫需求: 台灣 HR+/Her-2-晚期乳癌治療指引主要依循NCCN 及台灣乳房醫學會專家共識之治療指南,其中,CDK4/6抑制劑聯合內分泌療法已是標準第一線治療,但長期使用將引發的雙重抗藥性,限縮第二線治療的選擇。
提供治療新選擇: Tucidinostat是唯一屬於多靶點基因調控的表觀遺傳調控劑,已被台灣乳房醫學會專家共識推薦為第二線治療的首選(A級)
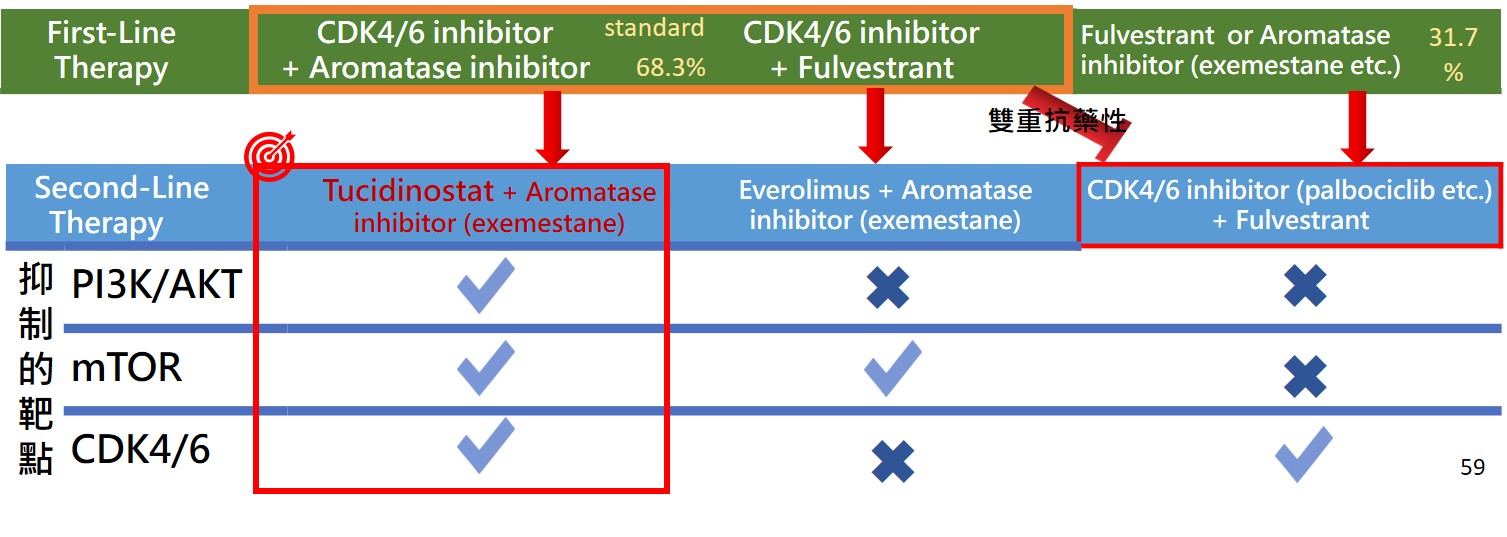
臨床相對療效: 剋必達®是毫不遜色於CDK4/6抑制劑